Page 120 - Saberes y Raíces - Química 3
P. 120
P-P
Enlace metálico, el mar de electrones
Aquí hay más información. Ya estamos a punto
de terminar la lección. ¡Sigue adelante!
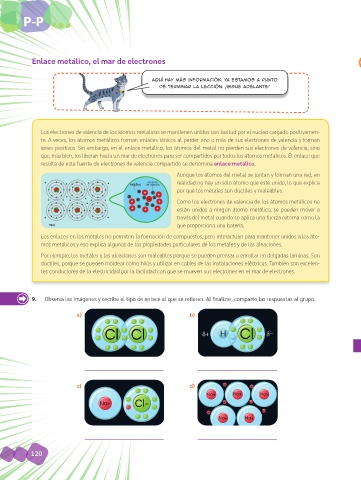
Los electrones de valencia de los átomos metálicos se mantienen unidos con laxitud por el núcleo cargado positivamen-
te. A veces, los átomos metálicos forman enlaces iónicos al perder uno o más de sus electrones de valencia y forman
iones positivos. Sin embargo, en el enlace metálico, los átomos del metal no pierden sus electrones de valencia, sino
que, más bien, los liberan hacia un mar de electrones para ser compartidos por todos los átomos metálicos. El enlace que
resulta de esta fuente de electrones de valencia compartido se denomina enlace metálico.
Aunque los átomos del metal se juntan y forman una red, en
electrón realidad no hay un sólo átomo que esté unido, lo que explica
núcleo de valencia
por qué los metales son dúctiles y maleables.
Como los electrones de valencia de los átomos metálicos no
están unidos a ningún átomo metálico, se pueden mover a
través del metal cuando se aplica una fuerza externa como la
(NA) que proporciona una batería.
Los enlaces en los metales no permiten la formación de compuestos, pero interactúan para mantener unidos a los áto-
mos metálicos y eso explica algunas de las propiedades particulares de los metales y de las aleaciones.
Por ejemplo, los metales y las aleaciones son maleables porque se pueden prensar o enrollar en delgadas láminas. Son
dúctiles, porque se pueden moldear como hilos y utilizar en cables de las instalaciones eléctricas. También son excelen-
tes conductores de la electricidad por la facilidad con que se mueven sus electrones en el mar de electrones.
9. Observa las imágenes y escribe el tipo de enlace al que se refieren. Al finalizar, comparte las respuestas al grupo.
a) b)
c) d)
120