Page 119 - Saberes y Raíces - Química 3
P. 119
L-17
L-1
7. Lee el siguiente caso y responde responde en tu cuaderno.
Considera una lucha de tira y afloja entre un luchador de sumo de 135 kg
en un extremo de la cuerda y otro luchador de 180 kg en el otro extremo.
a) ¿Quién jala más fuerte?
b) ¿Consideras que sería igual un enlace iónico o covalente? Explica tu respuesta.
c) Al finalizar, socialicen las respuestas e investiguen en fuentes confiables los tipos de enlaces covalentes que hay.
Cuando la diferencia de electronegatividad entre los átomos de un enlace está entre 0.5 y 2.0, la desigualdad con que se
comparten los electrones no es tan grande como para que se produzca una transferencia completa de electrones (enlace
iónico). Más bien, se produce una transferencia parcial de los electrones compartidos hacia el átomo más electronega-
tivo. El átomo menos electronegativo aún tiene cierta atracción por los electrones compartidos. El enlace que se forma
cuando los electrones no se comparten igual se llama enlace covalente polar.
Este tipo de enlaces covalentes se llaman polares porque al compartir desigualmente los elec-
trones se generan dos polos en el enlace, así como en una pila o una batería de un automóvil,
el enlace covalente polar también tiene dos polos.
El polo negativo está centrado sobre el átomo más electronegativo del enlace. Este átomo
comparte un electrón adicional. El polo positivo está centrado en el átomo menos electrone-
gativo. Este átomo ha dejado de compartir uno de sus electrones. Como no hay una transferen-
+
–
+
–
cia completa de electrón, las cargas en los polos no son 1 y 1 , sino δ y δ . Estos símbolos, del-
ta más y delta menos representan una carga parcial positiva y una carga parcial negativa.
Las cargas del enlace covalente polar le confieren un cierto carácter iónico, por lo que tienen
propiedades distintas a las de los compuestos con enlaces covalentes puros. Ya se vio que los
compuestos covalentes puros tienden a presentar bajos puntos de fusión y de ebullición. El
agua es una molécula con enlaces covalentes polares formada por tres átomos y su punto de
ebullición es de 100 °C.
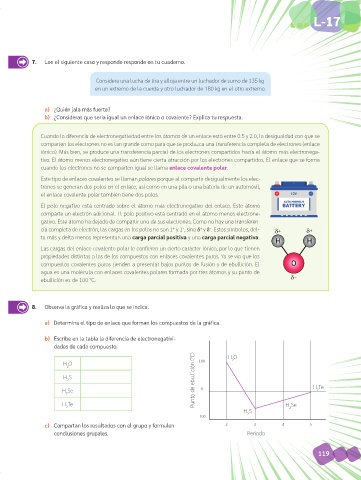
8. Observa la gráfica y realiza lo que se indica.
a) Determina el tipo de enlace que forman los compuestos de la gráfica.
b) Escribe en la tabla la diferencia de electronegativi-
dades de cada compuesto.
2
H O 100 H O
2
H S
2 Punto de ebullición (°C)
2
H Se 0 H Te
2
H Te H Se
2 2
H S
2
-100
c) Compartan los resultados con el grupo y formulen 2 3 4 5
conclusiones grupales. Periodo
119