Page 95 - Saberes y Raíces - Química 3
P. 95
L-13
L-1
La energía de los iones
La aportación de Lewis es importante porque explica la estabilidad de los átomos. Tú ya sabes qué es un
compuesto iónico o un ion, así que reflexiona sobre esto: ¿se le puede quitar un electrón a un elemento?, ¿cómo
sería esto? La energía de ionización se necesita para quitar un electrón de un átomo en estado gaseoso. Se utiliza la
definición para este estado físico, porque hay más espacio entre sus partículas. Es una medida de qué tan fuertemente
está unido el electrón al átomo en cuestión. Por tanto, a mayor energía de ionización, más difícil es quitarle un
electrón a un átomo.
De cuántos electrones posea un átomo dependerá cuántas energías de ionización tendrá. ¿Cómo es esto? Realiza la
siguiente actividad para averiguarlo.
6. Lee y responde en tu cuaderno.
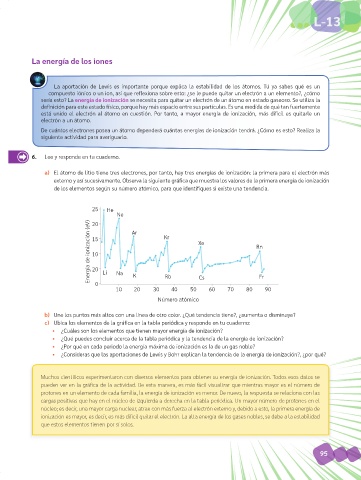
a) El átomo de litio tiene tres electrones, por tanto, hay tres energías de ionización: la primera para el electrón más
externo y así sucesivamente. Observa la siguiente gráfica que muestra los valores de la primera energía de ionización
de los elementos según su número atómico, para que identifiques si existe una tendencia.
25 He
Ne Ar
Energía de ionización (eV) 15 Kr Xe Rn
20
10
20
0 Li Na K Rb Cs Fr
10 20 30 40 50 60 70 80 90
Número atómico
b) Une los puntos más altos con una línea de otro color. ¿Qué tendencia tiene?, ¿aumenta o disminuye?
c) Ubica los elementos de la gráfica en la tabla periódica y responde en tu cuaderno:
• ¿Cuáles son los elementos que tienen mayor energía de ionización?
• ¿Qué puedes concluir acerca de la tabla periódica y la tendencia de la energía de ionización?
• ¿Por qué en cada periodo la energía máxima de ionización es la de un gas noble?
• ¿Consideras que las aportaciones de Lewis y Bohr explican la tendencia de la energía de ionización?, ¿por qué?
Muchos científicos experimentaron con diversos elementos para obtener su energía de ionización. Todos esos datos se
pueden ver en la gráfica de la actividad. De esta manera, es más fácil visualizar que mientras mayor es el número de
protones en un elemento de cada familia, la energía de ionización es menor. De nuevo, la respuesta se relaciona con las
cargas positivas que hay en el núcleo de izquierda a derecha en la tabla periódica. Un mayor número de protones en el
núcleo; es decir, una mayor carga nuclear, atrae con más fuerza al electrón externo y, debido a esto, la primera energía de
ionización es mayor, es decir, es más difícil quitar el electrón. La alta energía de los gases nobles, se debe a la estabilidad
que estos elementos tienen por sí solos.
95